
Inhaltsverzeichnis:
- Autor Miles Stephen [email protected].
- Public 2024-01-18 08:12.
- Zuletzt bearbeitet 2025-01-22 16:55.
Ideale Gasgesetzformel
- Ideales Gasgesetz Formelfragen:
- Antwort: Das Volumen beträgt V = 890,0 ml, die Temperatur T = 21 °C und der Druck P = 750 mmHg.
- PV = nRT.
- Antwort: Die Molzahl beträgt n = 3,00 Mol, die Temperatur ist T = 24°C und der Druck ist P = 762,4 mmHg.
- PV = nRT.
Wie berechnet man außerdem das ideale Gasgesetz?
Die Eigenschaften eines idealen Gases sind alle in einer Formel der Form pV = nRT dargestellt, wobei:
- p ist der Druck des Gases, gemessen in Pa,
- V ist das Volumen des Gases, gemessen in m^3,
- n ist die Stoffmenge, gemessen in Mol,
- R ist die ideale Gaskonstante und.
- T ist die Temperatur des Gases, gemessen in Kelvin.
Warum ist auch das ideale Gasgesetz wichtig? Boyles Gesetz besagt, dass bei konstanter Temperatur der Druck und das Volumen einer festen Probe von a Gas sind umgekehrt proportional (P1 x V1 = P2 x V2). Die Bedeutung ist also, dass die Ideales Gasgesetz berechnet das Verhalten von jedem Gas unter üblichen Temperatur- und Druckbedingungen.
Die Frage ist auch, wie man den Druck mit dem idealen Gasgesetz findet.
Sehen wir uns zuerst die Ideales Gasgesetz , PV = nRT. In dieser Gleichung ist 'P' der Druck in Atmosphären, 'V' ist das Volumen in Litern, 'n' ist die Anzahl der Teilchen in Mol, 'T' ist die Temperatur in Kelvin und 'R' ist die ideales Gas konstant (0,0821 Liter Atmosphären pro Mol Kelvin).
Was sind die Einheiten für das ideale Gasgesetz?
In SI-Einheiten wird p in gemessen Pascal , V wird in Kubikmetern gemessen, n wird in Mol gemessen und T in Kelvin (das Kelvin Maßstab ist ein verschobener Celsius Skala, wobei 0,00 K = -273,15 °C, die niedrigste mögliche Temperatur). R hat den Wert 8,314 J/(K. mol) ≈ 2 cal/(K.
Empfohlen:
Wie löst man das Multiplizieren und Dividieren von Brüchen?
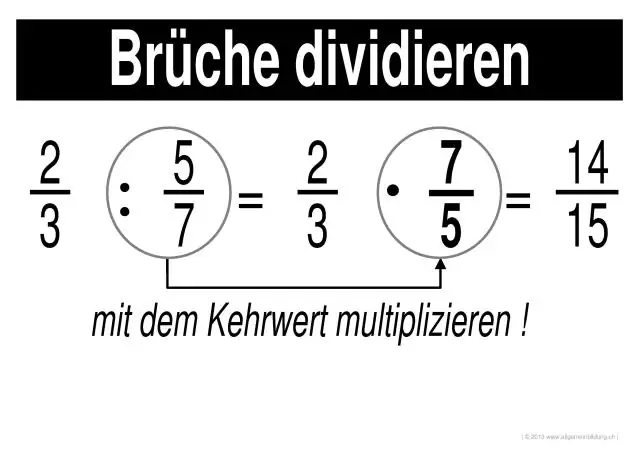
Brüche multiplizieren und dividieren Schritt 1: Multiplizieren Sie die Zähler von jedem Bruch miteinander (die Zahlen oben). Das Ergebnis ist der Zähler der Antwort. Schritt 2: Multiplizieren Sie die Nenner jedes Bruchs miteinander (die Zahlen unten). Das Ergebnis ist der Nenner der Antwort. Schritt 3: Vereinfachen oder reduzieren Sie die Antwort
Was ist das ideale Gasgesetz in der Chemie?

Ein ideales Gas ist ein hypothetisches Gas, von dem Chemiker und Studenten träumen, weil es viel einfacher wäre, wenn Dinge wie intermolekulare Kräfte nicht existieren würden, um das einfache Gesetz des idealen Gases zu komplizieren. Ideale Gase sind im Wesentlichen punktförmige Massen, die sich in einer konstanten, zufälligen, geradlinigen Bewegung bewegen
Wie löst man das Gesetz von Avogadro?

Bei konstantem Druck und konstanter Temperatur kann das Gesetz von Avogadro durch die folgende Formel ausgedrückt werden: V ∝ n. V/n = k. V1/n1 = V2/n2 (= k, nach dem Gesetz von Avogadro). PV = nRT. V/n = (RT)/P. V/n = k. k = (RT)/P. Ein Mol Heliumgas füllt einen leeren Ballon auf ein Volumen von 1,5 Litern
Wie löst man das Massenproblem der begrenzenden Reaktantenmasse?

Finden Sie das limitierende Reagens, indem Sie die Produktmenge berechnen und vergleichen, die jeder Reaktant produzieren wird. Balancieren Sie die chemische Gleichung für die chemische Reaktion. Wandle die gegebenen Informationen in Maulwürfe um. Verwenden Sie die Stöchiometrie für jeden einzelnen Reaktanten, um die Masse des produzierten Produkts zu ermitteln
Wie löst man den Koeffizienten, indem man das Quadrat vervollständigt?

Nun können wir eine quadratische Gleichung in 5 Schritten lösen: Schritt 1 Dividiere alle Terme durch a (den Koeffizienten von x2). Schritt 2 Verschieben Sie den Zahlenterm (c/a) auf die rechte Seite der Gleichung. Schritt 3 Vervollständigen Sie das Quadrat auf der linken Seite der Gleichung und gleichen Sie dies aus, indem Sie den gleichen Wert zur rechten Seite der Gleichung hinzufügen
