
Inhaltsverzeichnis:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Finden Sie das limitierende Reagens, indem Sie die Produktmenge berechnen und vergleichen, die jeder Reaktant produzieren wird
- Balancieren Sie die chemische Gleichung für die chemische Reaktion.
- Wandle die gegebenen Informationen in Maulwürfe um.
- Verwenden Sie die Stöchiometrie für jedes Individuum Reaktionspartner um die zu finden Masse des Produkts hergestellt.
Kann die prozentuale Ausbeute von über 100 erklären?
Typischerweise Prozent Rendite sind verständlich weniger als 100 % aus den oben genannten Gründen. Jedoch, Prozenterträge über 100 % sind möglich, wenn das gemessene Reaktionsprodukt Verunreinigungen enthält, die dazu führen, dass seine Masse größer als es tatsächlich möchten sein, wenn das Produkt rein wäre.
Wissen Sie auch, was ein limitierendes Reaktantenbeispiel ist? Begrenzender Reaktant - Die Reaktionspartner in einer chemischen Reaktion, die die Produktmenge begrenzt, die gebildet werden kann. Die Reaktion hört auf, wenn alle begrenzender Reaktant wird verbraucht. Überschuss Reaktant - Die Reaktionspartner in einer chemischen Reaktion, die bleibt, wenn eine Reaktion stoppt, wenn die begrenzender Reaktant wird komplett verbraucht.
In ähnlicher Weise können Sie sich fragen, was das limitierende Reagenz an einem Beispiel erklärt?
Begrenzende Reagenz :-Es ist definiert als Substanz, die vollständig verbraucht wird, wenn die chemische Reaktion abgeschlossen ist. Und das gebildete Produkt ist dadurch begrenzt Reagens , und Reaktion ist nicht möglich ohne begrenzende Reagenz . ZUM BEISPIEL :- C+O----CO. 1 mol +1 mol-----1 mol.
Wie bestimmst du den prozentualen Ertrag?
Um die Effizienz einer Reaktion auszudrücken, können Sie die prozentuale Ausbeute mit dieser Formel: % Ertrag = (tatsächlich Ertrag /theoretisch Ertrag ) x 100. A prozentuale Ausbeute von 90 % bedeutet, dass die Reaktion zu 90 % effizient war und 10 % der Materialien verschwendet wurden (sie reagierten nicht oder ihre Produkte wurden nicht eingefangen).
Empfohlen:
Wie löst man das ideale Gasgesetz?

Ideale Gasgesetzformel Ideale Gasgesetzformel Fragen: Antwort: Das Volumen ist V = 890,0 ml und die Temperatur ist T = 21°C und der Druck ist P = 750 mmHg. PV = nRT. Antwort: Die Molzahl beträgt n = 3,00 Mol, die Temperatur ist T = 24°C und der Druck ist P = 762,4 mmHg. PV = nRT
Wie löst man das Multiplizieren und Dividieren von Brüchen?
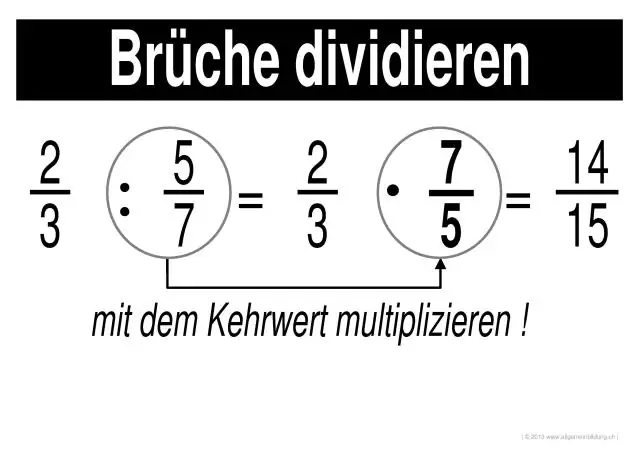
Brüche multiplizieren und dividieren Schritt 1: Multiplizieren Sie die Zähler von jedem Bruch miteinander (die Zahlen oben). Das Ergebnis ist der Zähler der Antwort. Schritt 2: Multiplizieren Sie die Nenner jedes Bruchs miteinander (die Zahlen unten). Das Ergebnis ist der Nenner der Antwort. Schritt 3: Vereinfachen oder reduzieren Sie die Antwort
Wie löst man das Gesetz von Avogadro?

Bei konstantem Druck und konstanter Temperatur kann das Gesetz von Avogadro durch die folgende Formel ausgedrückt werden: V ∝ n. V/n = k. V1/n1 = V2/n2 (= k, nach dem Gesetz von Avogadro). PV = nRT. V/n = (RT)/P. V/n = k. k = (RT)/P. Ein Mol Heliumgas füllt einen leeren Ballon auf ein Volumen von 1,5 Litern
Wie löst man den Koeffizienten, indem man das Quadrat vervollständigt?

Nun können wir eine quadratische Gleichung in 5 Schritten lösen: Schritt 1 Dividiere alle Terme durch a (den Koeffizienten von x2). Schritt 2 Verschieben Sie den Zahlenterm (c/a) auf die rechte Seite der Gleichung. Schritt 3 Vervollständigen Sie das Quadrat auf der linken Seite der Gleichung und gleichen Sie dies aus, indem Sie den gleichen Wert zur rechten Seite der Gleichung hinzufügen
Wie löst man ein lineares Programmierproblem mit der Methode der Ecken?
DIE METHODE DER ECKEN Zeichnen Sie die zulässige Menge (Region) S. Finden Sie die EXAKTen Koordinaten aller Eckpunkte (Eckpunkte) von S. Bewerten Sie die Zielfunktion P an jedem Eckpunkt Das Maximum (falls vorhanden) ist der größte Wert von P an einem Scheitelpunkt. Das Minimum ist der kleinste Wert von P an einer Ecke
