
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Jeder Hülse kann nur eine feste Anzahl von enthalten Elektronen : Der erste Hülse kann bis zu zwei aufnehmen Elektronen , der Zweite Hülse kann bis zu acht (2 + 6) aufnehmen Elektronen , der dritte Hülse kann bis zu 18 (2 + 6 + 10) und so weiter halten. Die allgemeine Formel lautet, dass nth Hülse kann im Prinzip bis zu 2(n2) Elektronen.
Zu wissen ist auch, was ist eine Schale in Elektronenkonfiguration?
Ein Elektronenhülle ist der äußere Teil eines Atoms um den Atomkern herum. Es ist, wo die Elektron s sind, und ist eine Gruppe von Atomorbitalen mit dem gleichen Wert der Hauptquantenzahl n.
Wie viele Elektronen befinden sich in jeder Schale? Jede Schale kann nur eine feste Anzahl von enthalten Elektronen : Der erste Hülse kann bis zu zwei aufnehmen Elektronen , der Zweite Hülse kann bis zu acht (2 + 6) aufnehmen Elektronen , der dritte Hülse kann bis zu 18 (2 + 6 + 10) und so weiter halten. Die allgemeine Formel lautet, dass nth Hülse kann im Prinzip bis zu 2(n2) Elektronen.
Zweitens, wie kann man sagen, wie viele Valenzelektronen ein Element hat?
Für neutrale Atome ist die Zahl der Valenzelektronen gleich der Hauptgruppennummer des Atoms ist. Die Hauptgruppennummer für an Element kann aus seiner Spalte im Periodensystem gefunden werden. Kohlenstoff ist zum Beispiel in Gruppe 4 und hat 4 Valenzelektronen . Sauerstoff ist in Gruppe 6 und hat 6 Valenzelektronen.
Warum gibt es nur 8 Elektronen in der äußeren Schale?
Die acht- Elektronen Die Stabilität eines Atoms leitet sich von der Stabilität der Edelgase oder des älteren Namens Inertgase ab, die seit langem als unreaktiv oder edel bekannt waren. Diese Regel ist jedoch für Elemente der zweiten Reihe des Periodensystems gerechtfertigt, die ihre äußerste - Hülse Kapazität ist 8 Elektronen.
Empfohlen:
Wie findet man die Komponentenform eines Vektors bei gegebenem Betrag und Winkel?
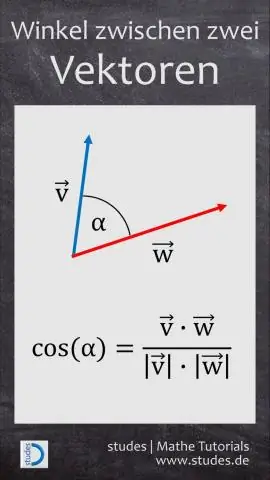
VIDEO Ist 0 in Anbetracht dessen ein Einheitsvektor? EIN Einheitsvektor ist ein Vektor die eine Größe von 1 hat. Die Notation repräsentiert die Norm oder Größe von Vektor v. Das Grundlegende Einheitsvektoren bin ich = (1, 0 ) und j = ( 0 , 1), die die Länge 1 haben und Richtungen entlang der positiven x-Achse bzw.
Wie findet man die Basiswinkel eines gleichschenkligen Trapezes?

Die Basen (oben und unten) eines Gleichschenkelstrapezoids sind parallel. Gegenüberliegende Seiten eines Gleichschenkelstrapezoids sind gleich lang (kongruent). Die Winkel auf beiden Seiten der Basen sind gleich groß/gleich (kongruent)
Was ist das kleinste Teilchen eines Elements, das die Eigenschaften des Elements beibehält?

Ein Atom ist das kleinste Teilchen eines Elements, das noch die Eigenschaften dieses Elements behält. Ein Stück eines Elements, das wir sehen oder handhaben können, besteht aus vielen, vielen Atomen und alle Atome sind gleich, sie haben alle die gleiche Anzahl von Protonen
Wie findet man die Oberfläche eines Festkörpers?
Um die Oberfläche eines Prismas (oder eines anderen geometrischen Festkörpers) zu ermitteln, öffnen wir den Festkörper wie einen Karton und glätten ihn, um alle enthaltenen geometrischen Formen zu finden. Um das Volumen eines Prismas (egal ob rechteckig oder dreieckig) zu bestimmen, multiplizieren wir die Grundfläche, die so genannte Grundfläche B, mit der Höhe h
Wie findet man die Ionen eines Elements?

Subtrahieren von Elektronen von Protonen Subtrahieren Sie die Anzahl der Elektronen von der Anzahl der Protonen in einem Atom als grundlegende Methode zur Berechnung der Ladung des Ions. Wenn beispielsweise ein Natriumatom ein Elektron verliert, gilt die Trainingseinheit 11 - 10 = 1. Ein Natriumion hat eine Ladung von +1, notiert als Na+
