- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:33.
- Zuletzt bearbeitet 2025-01-22 16:55.
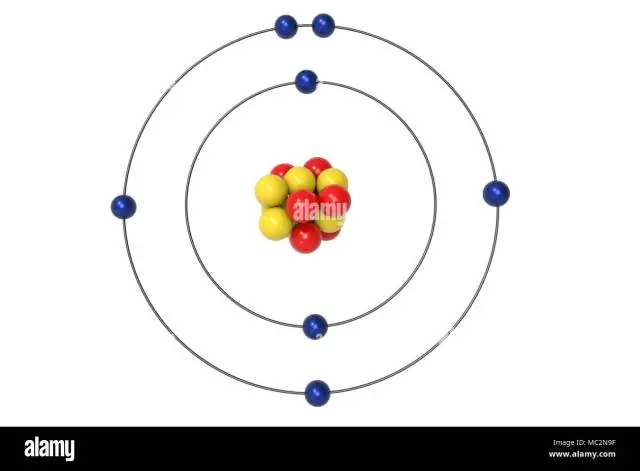
Die restlichen drei Elektronen gehen in das 2p-Orbital. Daher ist die N-Elektronenkonfiguration 1s22s22p3. Die Konfiguration Notation für Stickstoff (N) bietet Wissenschaftlern eine einfache Möglichkeit, zu schreiben und zu kommunizieren, wie Elektronen um den Kern des Stickstoffatoms angeordnet sind.
Wie ist hier die Valenzelektronenkonfiguration für das Stickstoffatom?
[Er] 2s2 2p3
Man kann sich auch fragen, warum die Wertigkeit von Stickstoff 5 beträgt. Stickstoff hat entweder 3 oder 5 Wertigkeit Elektronen und liegt an der Spitze der Gruppe 15 des Periodensystems. Es kann entweder 3 oder haben 5 Wertigkeit Elektronen, weil es in den äußeren 2p- und 2s-Orbitalen binden kann. Stickstoff bildet die DNA in Form von stickstoffhaltigen Basen sowie in Neurotransmittern.
Anschließend stellt sich die Frage, was die Kernvalenzelektronenkonfiguration für Kalium ist.
Daher, Kalium hat eine Elektronenkonfiguration von [Ar]4s1. Somit, Kalium entspricht Li und Na in seiner Konfiguration der Valenzschale . Der nächste Elektron wird hinzugefügt, um die 4s-Unterschale zu vervollständigen und Calcium hat eine Elektronenkonfiguration von [Ar]4s2.
Wie bestimmt man die Wertigkeit?
Die Wertigkeit eines Atoms ist gleich der Anzahl der Elektronen in der äußeren Schale, wenn diese Zahl vier oder weniger beträgt. Ansonsten der Wertigkeit gleich acht minus der Anzahl der Elektronen in der äußeren Schale. Sobald Sie die Anzahl der Elektronen kennen, können Sie leicht Berechnung das Wertigkeit.
Empfohlen:
Wie lautet die Formel für zweiatomigen Stickstoff?

Antwort und Erklärung: Stickstoff ist ein Beispiel für ein zweiatomiges Molekül. Die chemische Formel für Stickstoffgas ist N2. Die anderen zweiatomigen Moleküle sind Wasserstoff, Sauerstoff
Wie hoch ist die formale Ladung von Stickstoff in dieser Struktur?

Weiter mit dem Stickstoff beobachten wir, dass in (a) das Stickstoffatom drei Bindungspaare teilt und ein einsames Paar hat und insgesamt 5 Valenzelektronen besitzt. Die formale Ladung des Stickstoffatoms beträgt daher 5 - (2 + 6/2) = 0. In (b) hat das Stickstoffatom eine formale Ladung von -1
Wie groß ist die Ionisierungsenergie kJ mol von Stickstoff?

Die Ionisierungsenergie von molekularem Stickstoff beträgt 1503 kJ mol&supmin; und die von atomarem Stickstoff beträgt 1402 kJ mol&supmin;. Auch hier ist die Energie der Elektronen im molekularen Stickstoff niedriger als die der Elektronen in den getrennten Atomen, das Molekül ist also gebunden
Was gilt sowohl für die Photosynthese als auch für die Zellatmung, die Sauerstoff als Reaktionspartner benötigen?

Die richtige Antwort lautet: „Sie benötigen Organellen“. Die Mitochondrien sind die Organelle, die die Atmung erleichtern, und die Chloroplasten erleichtern die Photosynthese. Die Zellatmung erfordert Sauerstoffreaktanten, die Photosynthese erfordert Kohlendioxid. Die Photosynthese benötigt Lichtenergie von der Sonne, nicht die Atmung
Was ist die stärkste intermolekulare Kraft in Stickstoff?

Erklärung: Die stärkste der aufgeführten Wasserstoffbrückenbindungen. Diese Art von intermolekularer Kraft ist die Anziehung, die zwischen Wasserstoffatomen und den einsamen Paaren von Sauerstoff-, Stickstoff- und/oder Fluoratomen auftritt. Wasserstoffbrückenbindungen sind am stärksten, während Dispersionskräfte am schwächsten sind
