
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Beachten Sie einen wichtigen Unterschied zwischen den allgemeinen Phasendiagramm und der Phasendiagramm zum Wasser . Der Grund ist, dass Wasser ist eine ungewöhnliche Substanz, da ihr fester Zustand weniger dicht ist als der flüssige Zustand. Eis schwimmt in Flüssigkeit Wasser . Daher hat eine Druckänderung den gegenteiligen Effekt auf diese beiden Phasen.
Wie unterscheidet sich davon das Phasendiagramm von Wasser von den anderen Stoffen?
Die Phasendiagramm für die meisten Substanzen sieht aus wie das. Somit zeigt die negative Steigung an, dass die Flüssigkeit Phase hat eine größere Dichte als der Festkörper Phase . Mit anderen Worten, die Dichte von Eis ist geringer als die von Wasser . Für die meisten anderen gängigen Substanzen , der Feststoff ist dichter als die Flüssigkeit.
Wie unterscheiden sich die Phasendiagramme für Wasser und Kohlendioxid? nicht wie Kohlendioxid und die meisten anderen Stoffe, die Phasendiagramm von Wasser zeigt eine negative Steigung für die Grenzlinie zwischen flüssigem und festem Zustand. Dies Unterschied muss tun mit der Tatsache, dass Wasser dehnt sich tatsächlich beim Übergang vom flüssigen in den festen Zustand aus.
Was ist der Zweck eines Phasendiagramms?
EIN Phasendiagramm in der physikalischen Chemie, den Ingenieurwissenschaften, der Mineralogie und den Materialwissenschaften ist eine Art Diagramm, das verwendet wird, um Bedingungen (Druck, Temperatur, Volumen usw.) Phasen (wie fester, flüssiger oder gasförmiger Zustand) treten auf und koexistieren bei Gleichgewicht.
Warum sind die Phasendiagramme für jede Substanz unterschiedlich?
Bei der Auswertung der Phasendiagramm , es ist erwähnenswert, dass die fest-flüssig Phase Grenze in der Phasendiagramm von den meisten Substanzen hat eine positive Steigung. Das liegt an der festen Phase eine höhere Dichte als die Flüssigkeit aufweisen, so dass eine Erhöhung des Drucks die Schmelztemperatur erhöht.
Empfohlen:
Warum kriecht das Wasser das Papier hoch?

Durch Kapillarwirkung kriecht Wasser auf dem Papier nach oben. Dies ist der Fall, wenn die Bindung der Moleküle einer Flüssigkeit an sich selbst geringer ist als die Anziehungskraft einer anderen Substanz, die die Moleküle berühren. Das Natriumbitartrat enthält ein Natriumion, drei Hydroxylgruppen und zwei Doppelbindungen
Warum werden das Zerreißen von Papier und das Verbrennen von Papier als zwei Arten von Veränderungen betrachtet?

Das Reißen eines Papiers ist eine physikalische Veränderung, da beim Zerreißen des Papiers nur das Aussehen des Papiers verändert wird und keine neue Substanz gebildet wird. Das Zerreißen von Papier ist eine physikalische Veränderung, weil es gleich bleibt, aber das Verbrennen von Papier ist eine chemische Veränderung, weil es sich in Asche verwandelt
Wie ist das Teilen von rationalen Zahlen wie das Teilen von ganzen Zahlen?

Multiplizieren Sie einfach die absoluten Werte und machen Sie die Antwort negativ. Wenn Sie zwei ganze Zahlen mit gleichem Vorzeichen dividieren, ist das Ergebnis immer positiv. Teilen Sie einfach die absoluten Werte und machen Sie die Antwort positiv. Wenn Sie zwei ganze Zahlen mit unterschiedlichen Vorzeichen teilen, ist das Ergebnis immer negativ
Warum ist das Anhaften von Wasser lebenswichtig?

Die Adhäsionseigenschaft von Wasser ermöglicht es Wasser, dass Wassermoleküle an Nicht-Wassermolekülen haften, was zu einigen üblichen Wasserverhalten führt. Durch Adhäsion kann sich Wasser entgegen der Schwerkraft durch Pflanzenzellen bewegen. Die Kapillarwirkung aufgrund der Adhäsion ermöglicht es dem Blut, sich in einigen Tierkörpern durch winzige Gefäße zu bewegen
Warum hat Wasser ein Phasendiagramm mit negativer Steigung?
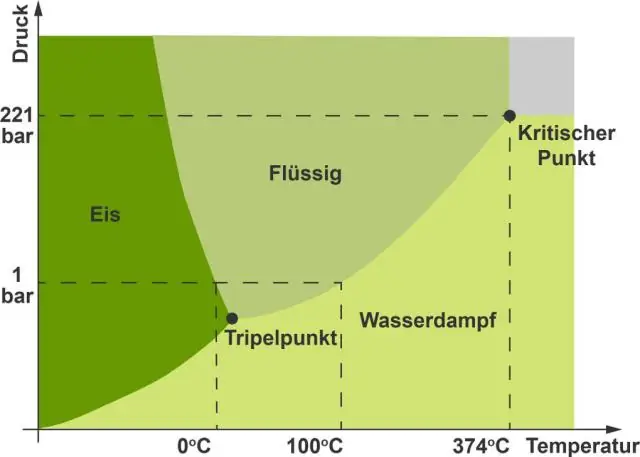
Im Wasserdiagramm ist die Steigung der Linie zwischen dem festen und dem flüssigen Zustand eher negativ als positiv. Der Grund dafür ist, dass Wasser eine ungewöhnliche Substanz ist, da sein fester Zustand weniger dicht ist als der flüssige Zustand
