
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Dieser Rechner berechnet den Einfluss der Temperatur auf die Reaktionsgeschwindigkeit unter Verwendung der Arrhenius Gleichung. k=A*exp(-Eein/R*T) wobei k der Geschwindigkeitskoeffizient ist, A ist a Konstante , Eein ist die Aktivierungsenergie, R ist das universelle Gas Konstante , und T ist die Temperatur (in Kelvin). R hat den Wert 8,314 x 10-3 kJ mol-1K-1.
Welchen Wert hat in diesem Zusammenhang die Arrhenius-Konstante?
Die Wert des Gases Konstante , R, ist 8,31 J K-1 mol-1.
Anschließend stellt sich die Frage, wie findet man die Arrhenius-Konstante? Die Arrhenius-Gleichung ist k = Ae^(-Ea/RT), wobei A die Frequenz oder der präexponentielle Faktor ist und e^(-Ea/RT) der Bruchteil der Kollisionen ist, die genug Energie zum Reagieren haben (dh eine Energie größer als or. haben) gleich der Aktivierungsenergie Ea) bei der Temperatur T.
Wissen Sie auch, was A in der Arrhenius-Gleichung bedeutet?
Beachten Sie das Arrhenius-Gleichung wird manchmal als k = Ae. ausgedrückt-E/RT wo k ist der Geschwindigkeit der chemischen Reaktion, A ist eine Konstante in Abhängigkeit von den beteiligten Chemikalien, E ist der Aktivierungsenergie, R ist der universelle Gaskonstante und T ist der Temperatur.
Warum ist die Arrhenius-Gleichung wichtig?
Arrhenius-Gleichung ist so wichtig weil es uns erlaubt, diejenigen Faktoren zu berücksichtigen, die die Geschwindigkeit einer Reaktion beeinflussen, die wir in den Geschwindigkeitsgesetzen nicht sehen können, nämlich: Temperatur, Anwesenheit eines Katalysators, Energiebarriere, Häufigkeit und Ausrichtung von Kollisionen…
Empfohlen:
Warum ist die EMF Null, wenn die Spule genau durch die Mitte des Magneten läuft?
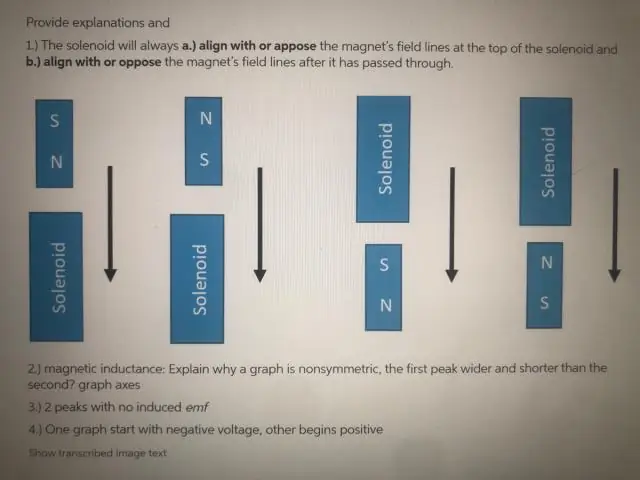
Die EMK ist nur für einen Moment Null, wenn der Magnet genau durch die Mitte der Spule geht. Dies liegt daran, dass die Wirkung des N-Pols am einen Ende des Magneten an diesem Ende der Spule durch die Wirkung des S-Pols des Magneten am anderen Ende der Spule genau aufgehoben wird
Was ist der Unterschied zwischen der Arrhenius-Definition und der Brønsted-Lowry-Definition von Säuren und Basen?

Der Unterschied zwischen den drei Theorien besteht darin, dass die Arrhenius-Theorie besagt, dass die Säuren immer H+ und die Basen immer OH- enthalten. Während das Bronsted-Lowry-Modell behauptet, dass Säuren Protonendonatoren und Pronakzeptoren sind, müssen Basen kein OH- enthalten, also geben Säuren ein Proton an Wasser ab und bilden H3O+
Welche Organelle ist für die chemische Energie verantwortlich, die die Zelle zum Funktionieren benötigt?

Funktion der Mitochondrien Mitochondrien werden oft als „Kraftwerke“oder „Energiefabriken“einer Zelle bezeichnet, weil sie für die Herstellung von Adenosintriphosphat (ATP) verantwortlich sind, dem Hauptenergieträger der Zelle
Was ist das Arrhenius-Konzept von Säuren und Basen?

Das Säure-Base-Konzept von Arrhenius stuft einen Stoff als Säure ein, wenn er in Wasser Wasserstoffionen H(+) oder Hydroniumionen produziert. Ein Stoff wird als Base eingestuft, wenn er in Wasser Hydroxidionen OH(-) produziert. Andere Möglichkeiten, Stoffe als Säuren oder Basen zu klassifizieren, sind das Bronsted-Lowry-Konzept und das Lewis-Konzept
Wie verwendet man die Arrhenius-Gleichung?

Wenn Sie diese Gleichung verwenden müssen, suchen Sie einfach die 'ln'-Schaltfläche auf Ihrem Taschenrechner. Sie können die Arrhenius-Gleichung verwenden, um den Einfluss einer Temperaturänderung auf die Geschwindigkeitskonstante - und damit auf die Reaktionsgeschwindigkeit - zu zeigen. Verdoppelt sich beispielsweise die Geschwindigkeitskonstante, so verdoppelt sich auch die Reaktionsgeschwindigkeit
