
Inhaltsverzeichnis:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:12.
- Zuletzt bearbeitet 2025-01-22 16:55.
Eigenschaften von Alkalimetallen
- Gefunden in Spalte 1A des Periodensystems.
- Verfügen über ein Elektron in ihrer äußersten Elektronenschicht.
- Leicht ionisiert.
- Silbrig, weich und nicht dicht.
- Niedrige Schmelzpunkte.
- Unglaublich reaktiv.
Zu wissen ist auch, was sind drei Eigenschaften von Alkalimetallen?
Eigenschaften von Alkalimetallen sind:
- Hochreaktive Metalle.
- In der Natur nicht frei zu finden.
- In einer Mineralöllösung gelagert.
- Niedrige Schmelzpunkte.
- Geringe Dichten (niedriger als bei anderen Metallen)
- Niedrige Elektronegativität.
- Niedrige Ionisierungsenergie.
- Reagiert leicht mit Halogenen.
Was sind außerdem die physikalischen Eigenschaften von Elementen der Gruppe 1? Die Elemente der Gruppe 1 sind alle weiche, reaktive Metalle mit niedrigem Schmelzpunkte . Sie reagieren mit Wasser zu einer Alkalimetallhydroxidlösung und Wasserstoff. Die Reaktivität nimmt in der Gruppe abwärts zu.
Was sind diesbezüglich die gemeinsamen physikalischen und chemischen Eigenschaften von Alkalimetallen?
Antworten
- Alkalimetalle sind weiche, helle und silbrig-weiße Metalle.
- ihre Dichten sind gering (wegen der Größe). es erhöht sich in der Gruppe nach unten.
- die Schmelz- und Siedepunkte von Alkalimetallen sind aufgrund der schwachen metallischen Bindung aufgrund des Vorhandenseins eines Elektrons in der Valenzschale niedrig.
Warum haben Alkalimetalle ähnliche Eigenschaften?
Alkalimetalle haben ähnliche Eigenschaften weil sie in der gleich Gruppe (Gruppe 1). Das bedeutet, dass sie verfügen über das gleich Anzahl der Valenzelektronen in ihrer äußersten Schale. Allerdings steigt die Reaktivität ab Gruppe 1 hinab, weil es für die Atome leichter ist, ihre Elektronen zu verlieren.
Empfohlen:
Welche unterschiedlichen physikalischen und chemischen Eigenschaften haben Mineralien?

Mineralien werden nach ihrer chemischen Zusammensetzung klassifiziert, die sich in ihren physikalischen Eigenschaften ausdrückt. Dieses Modul, das zweite in einer Reihe von Mineralien, beschreibt die physikalischen Eigenschaften, die üblicherweise zur Identifizierung von Mineralien verwendet werden. Dazu gehören Farbe, Kristallform, Härte, Dichte, Glanz und Spaltung
Welche physikalischen Eigenschaften haben alle Sterne?

Physikalische Eigenschaften, die alle Sterne besitzen: Sie bestehen aus Gasen wie Wasserstoff und Helium. Sie leuchten durch die Wechselwirkung von Wasserstoff und Helium bei entsprechendem Druck und Temperatur sehr hell. Sie enthalten Eisen in ihren Kernen, das die Fusionsreaktion überwacht
Welche der folgenden sind alle physikalischen Eigenschaften von Materie?
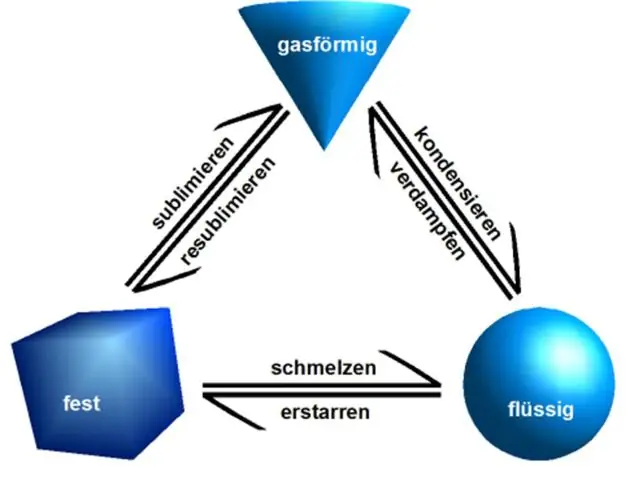
Physikalische Eigenschaften: Physikalische Eigenschaften können beobachtet oder gemessen werden, ohne die Zusammensetzung der Materie zu ändern. Zu den physikalischen Eigenschaften gehören: Aussehen, Textur, Farbe, Geruch, Schmelzpunkt, Siedepunkt, Dichte, Löslichkeit, Polarität und viele andere
Welche physikalischen Eigenschaften haben Mineralien?

Die folgenden physikalischen Eigenschaften von Mineralien können leicht verwendet werden, um ein Mineral zu identifizieren: Farbe. Strähne. Härte. Spaltung oder Bruch. Kristalline Struktur. Transparenz oder Transparenz. Beharrlichkeit. Magnetismus
Welche Eigenschaften haben Alkalimetalle?

Die Alkalimetalle sind eine Gruppe chemischer Elemente aus dem S-Block des Periodensystems mit ähnlichen Eigenschaften: Sie erscheinen silbrig und lassen sich mit einem Plastikmesser schneiden. Alkalimetalle sind bei Standardtemperatur und -druck hochreaktiv und verlieren leicht ihr äußerstes Elektron, um Kationen mit einer Ladung von +1 . zu bilden
