
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Die Chlor Isotop mit 18 Neutronen hat ein Fülle von 0,7577 und einer Massenzahl von 35 amu. Zu Berechnung die durchschnittliche Atommasse, multiplizieren Sie den Bruch mit der Massenzahl für jedes Isotop und addieren Sie sie dann zusammen.
Anschließend kann man sich auch fragen, wie berechnet man die prozentuale Häufigkeit?
Finden die durchschnittliche Atommasse eines Elements mit Isotopen Multiplizieren Sie die Masse jedes Isotops mit seiner Prozent Überfluss . Füge jedes Produkt von Massenzeiten hinzu Prozent Überfluss jedes Isotops. Diese Summe stellt die gewichtete durchschnittliche Atommasse des Elements dar.
Wie findet man auch die durchschnittliche Atommasse aus der prozentualen Häufigkeit? Die Fülle aller Isotope sollten sich auf 100 % summieren. Multiplizieren Sie die Masse mal die Fülle für jedes Isotop, addieren Sie dann alle Ergebnisse zusammen, um die durchschnittliche Atommasse.
Auch gefragt, wie hoch ist der prozentuale Anteil von Chlor 35?
Chlor . ( Chlor -37). Die viel Chlor - 35 ist 75% und die viel Chlor -37 ist 25%. Mit anderen Worten, alle 100 Chlor Atome, 75 Atome haben eine Massenzahl von 35 , und 25 Atome haben eine Massenzahl von 37.
Was bedeutet Prozent Überfluss?
Prozentualer Überfluss ist definiert als die Prozent Wert der in der Natur verfügbaren Isotopenmenge für ein bestimmtes Element.
Empfohlen:
Wie findet man die Teilmenge einer Menge?

Anzahl der Teilmengen einer gegebenen Menge: Wenn eine Menge 'n' Elemente enthält, dann beträgt die Anzahl der Teilmengen der Menge 22. Wenn eine Menge 'n' Elemente enthält, dann beträgt die Anzahl der richtigen Teilmengen der Menge 2n - 1 . Anzahl echter Teilmengen von A sind 3 = 22 - 1 = 4 - 1
Wie schreibt man eine unendliche Menge?

Beispiele für unendliche Menge: Die Menge aller Punkte in einer Ebene ist eine unendliche Menge. Die Menge aller Punkte in einem Liniensegment ist eine unendliche Menge. Die Menge aller positiven ganzen Zahlen, die ein Vielfaches von 3 ist, ist eine unendliche Menge. W = {0, 1, 2, 3, ……..} d.h. die Menge aller ganzen Zahlen ist eine unendliche Menge. N = {1, 2, 3, ……….} Z = {
Wie berechnet man die prozentuale Reinheit?
%Reinheit = g erhaltene Reinsubstanz ÷ gof gegebene Probe ×100. Die prozentuale Reinheit einer Substanz kann berechnet werden, indem die Masse der reinen Chemikalie durch die Gesamtmasse der Probe geteilt und diese Zahl dann mit 100 multipliziert wird
Wie berechnet man die Zeit, die man braucht, um eine Strecke zurückzulegen?

Schätzen Sie, wie schnell Sie auf Ihrer Reise sein werden. Dann teilen Sie Ihre Gesamtstrecke durch Ihre Geschwindigkeit. Dies gibt Ihnen eine Einschätzung Ihrer Reisezeit. Wenn Ihre Fahrt beispielsweise 240 Meilen beträgt und Sie 40 Meilen pro Stunde fahren werden, beträgt Ihre Zeit 240/40 = 6 Stunden
Wie berechnet man die prozentuale Molarität?
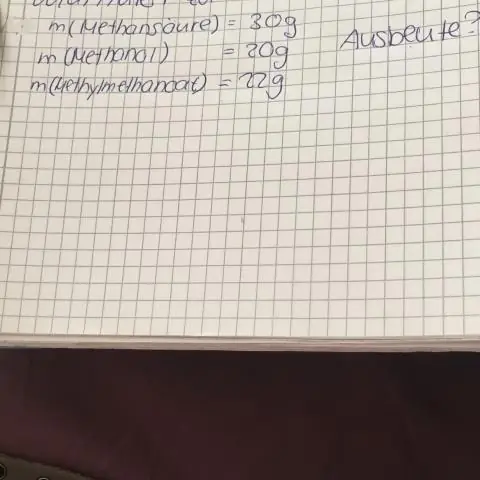
Mole und molare Lösungen (Einheit = M = Mol/L) Prozent Lösungen (% = Teile pro Hundert oder Gramm/100 ml) Um von % Lösung in Molarität umzurechnen, multiplizieren Sie die %Lösung mit 10, um die prozentuale Lösung Gramm/L auszudrücken, dann dividieren nach der Formel Gewicht
