
Inhaltsverzeichnis:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Kinetische molekulare Theorie besagt, dass sich Gasteilchen in ständiger Bewegung befinden und vollkommen elastische Stöße zeigen. Kinetische molekulare Theorie kann benutzt werden um erklären die Gesetze von Charles und Boyle. Der Durchschnitt kinetisch Die Energie einer Ansammlung von Gasteilchen ist nur der absoluten Temperatur direkt proportional.
Und was sind die Regeln der kinetischen Molekulartheorie?
Die Kinetische molekulare Theorie von Gasen wird in den folgenden vier Prinzipien angegeben: Der Raum zwischen Gas Moleküle ist viel größer als die Moleküle sich. Gas Moleküle sind in ständiger zufälliger Bewegung. Der Durchschnitt kinetisch Energie wird allein durch die Temperatur bestimmt.
Anschließend stellt sich die Frage, was ist das Quizlet zur kinetischen Molekulartheorie? EIN Theorie die das Verhalten, die Wechselwirkung und die Bewegung von Gas beschreibt Moleküle ; basierend auf der Idee, dass Materieteilchen immer in Bewegung sind; die Beziehung zwischen den mikroskopischen Eigenschaften und den makroskopischen Eigenschaften eines Gases. Gase sind meist leerer Raum und es wird angenommen, dass sie kein Volumen haben.
Warum ist die kinetische Molekulartheorie auf diese Weise wichtig?
Die Kinetische Theorie der Materie hilft uns zu erklären, warum Materie in verschiedenen Phasen (d. h. fest, flüssig und gasförmig) existiert und wie sich Materie von einer Phase in die nächste ändern kann. Die Kinetische Theorie der Materie hilft uns auch, andere Eigenschaften der Materie zu verstehen.
Was sind die vier Teile der kinetischen Theorie?
Die kinetische Theorie besteht aus drei Hauptkomponenten:
- Wenn Moleküle kollidieren, wird keine Energie gewonnen oder verloren.
- Die Moleküle in einem Gas nehmen im Verhältnis zu dem von ihnen besetzten Behälter einen vernachlässigbaren (vernachlässigbaren) Raum ein.
- Die Moleküle befinden sich in konstanter, linearer Bewegung.
Empfohlen:
Was ist die einfache Definition des Human Development Index?

Definition: Der Human Development Index (HDI) ist ein statistisches Instrument zur Messung der Gesamtleistung eines Landes in seiner sozialen und wirtschaftlichen Dimension. Die soziale und wirtschaftliche Dimension eines Landes basiert auf der Gesundheit der Menschen, ihrem Bildungsstand und ihrem Lebensstandard
Was ist die Einheit der kinetischen Rotationsenergie?
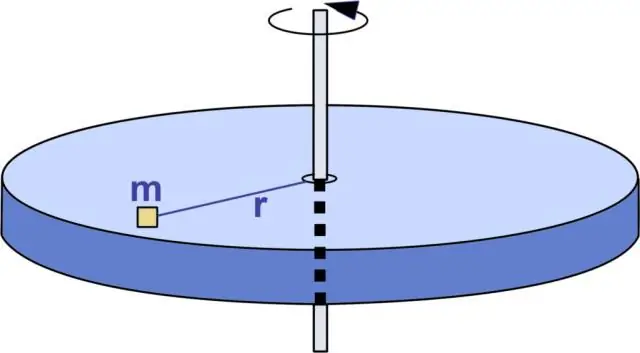
Die Einheit der kinetischen Energie ist Joule (J). In anderen Einheiten entspricht ein Joule einem Quadratkilometer pro Quadratsekunde (). Fragen zur kinetischen Rotationsenergieformel: 1) Ein runder Mühlstein mit einem Trägheitsmoment von I = 1500 kg∙m2 rotiert mit einer Winkelgeschwindigkeit von 8,00 Radiant/s
Was ist die einfache Definition von Ring of Fire?

Definition des Feuerrings Der Feuerring bezieht sich auf ein geographisches Gebiet mit hoher vulkanischer und seismischer Aktivität an den Rändern des Pazifischen Ozeans. Entlang dieses Rings sind Erdbeben und Vulkanausbrüche aufgrund von tektonischen Plattengrenzen und -bewegungen üblich
Was ist der Unterschied zwischen der Arrhenius-Definition und der Brønsted-Lowry-Definition von Säuren und Basen?

Der Unterschied zwischen den drei Theorien besteht darin, dass die Arrhenius-Theorie besagt, dass die Säuren immer H+ und die Basen immer OH- enthalten. Während das Bronsted-Lowry-Modell behauptet, dass Säuren Protonendonatoren und Pronakzeptoren sind, müssen Basen kein OH- enthalten, also geben Säuren ein Proton an Wasser ab und bilden H3O+
Was ist die einfachste Form der kinetischen Energie?

Die einfachste Form der kinetischen Energie ist die Energie eines ganzen bewegten Objekts. Es ist Teil von Mechanischer Energie
