
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Nehmen wir ein Beispiel für a Puffer bestehend aus der schwachen Basis Ammoniak , NH3 und seine konjugierte Säure, NH4+. Wann HCl (starke Säure) wird dazu gegeben Puffer System werden die zusätzlichen H+-Ionen, die dem System hinzugefügt werden, von den NH3 zu Form NH4+. Die weitere Zugabe einer Säure oder Base zum Puffer ändert seinen pH-Wert schnell.
Sind nh3 und NH4Cl ebenfalls eine Pufferlösung?
Antwort und Erklärung: Ammoniak und Ammoniumchlorid Puffer ist eine Mischung aus schwacher Säure und ihrem Salz. Es ist eine grundlegende Puffer weil die Basendissoziationskonstante für Ammoniak größer ist als die Säurekonstante für Ammoniumionen.
Um welche Art von Reaktion handelt es sich bei HCl und nh3? Daher NH3 bei Erhalt des H+ von HCl (H+ und Cl-) bildet NH4+ (Ammonium-Ion), das bei Bindung mit Cl--Ion (aus HCl ) ergibt NH4Cl (Ammoniumchlorid). Die Reaktion wird dargestellt als NH3 + HCl = NH4Cl.
Die Frage ist auch, welche Reaktion abläuft, wenn HCl zu Ammoniakpuffer hinzugefügt wird?
Die Salzsäure Säure würde heftig mit dem Ammoniak unter Bildung von Ammoniumchlorid (das ein sehr schwach saures Salz ist, im Allgemeinen harmlos) reagieren, die Basizität der Lösung neutralisieren, und es würde eine heftige Bildung von Wasserstoffgasblasen als Zischen der Lösung beobachtet werden.
Wie stellt man eine Ammoniakpufferlösung her?
Ammoniak -Ammoniumchlorid Puffer : 67,5 g Ammoniumchlorid in ca. 200 ml Wasser auflösen, 570 ml stark. zugeben Ammoniaklösung und mit Wasser auf 1000 ml verdünnen. Ammoniakpuffer pH 9,5: Lösen Sie 33,5 g Ammoniumchlorid in ISO ml Wasser und 42 ml 10M Ammoniak und mit Wasser auf 250 ml verdünnen.
Empfohlen:
Welche Lösung ist ein Puffer?

Eine Pufferlösung ist eine Lösung, die pH-Änderungen widersteht, wenn ihr kleine Mengen einer Säure oder eines Alkalis zugesetzt werden. Saure Pufferlösungen. Eine saure Pufferlösung ist einfach eine Lösung mit einem pH-Wert von weniger als 7. Saure Pufferlösungen werden üblicherweise aus einer schwachen Säure und einem ihrer Salze hergestellt – oft ein Natriumsalz
Warum funktioniert ein Puffer am besten bei einem pH-Wert in der Nähe seines pKa?
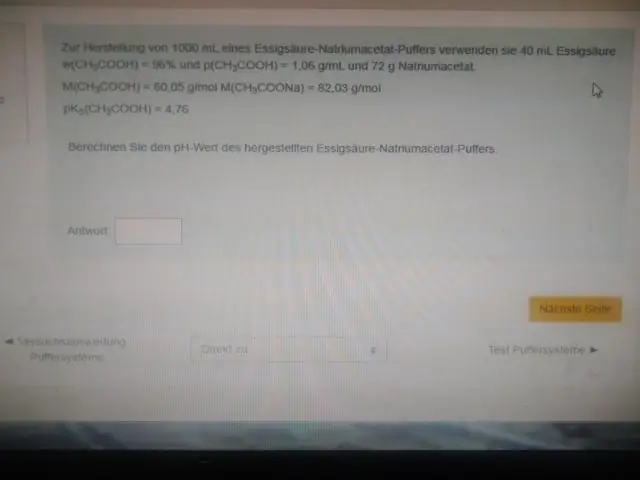
Mit anderen Worten, der pH-Wert der äquimolaren Säurelösung (z. B. wenn das Verhältnis der Konzentration von Säure und konjugierter Base 1:1 beträgt) ist gleich dem pKa. Dieser Bereich ist am effektivsten, um großen pH-Änderungen zu widerstehen, wenn entweder Säure oder Base hinzugefügt werden. Eine Titrationskurve zeigt visuell die Pufferkapazität
Wie stellt man einen Carbonat-Bicarbonat-Puffer her?

Karbonat-Bikarbonat-Puffer (pH 9,2 bis 10,6) Rezept und Zubereitung Bereiten Sie 800 ml destilliertes Wasser in einem geeigneten Behälter vor. 1,05 g Natriumbicarbonat zu der Lösung geben. 9,274 g Natriumcarbonat (wasserfrei) zu der Lösung geben. Fügen Sie destilliertes Wasser hinzu, bis das Volumen 1 L beträgt
Welche Ablagerungsmerkmale bilden sich, wenn ein Bach in einen See oder Ozean eintritt?

Beschreibung: Das Delta ist die Landschaftsform, die durch den Prozess der Ablagerung von Sedimenten gebildet wird, die von den frei fließenden Flüssen von Landschaftsformen getragen werden
Können eine starke Säure und eine schwache Base einen Puffer bilden?

Wie Sie bei der Berechnung des pH-Werts von Lösungen gesehen haben, ist nur eine geringe Menge einer starken Säure erforderlich, um den pH-Wert drastisch zu ändern. Ein Puffer ist einfach eine Mischung aus einer schwachen Säure und ihrer konjugierten Base oder einer schwachen Base und ihrer konjugierten Säure. Puffer funktionieren, indem sie mit jeder hinzugefügten Säure oder Base reagieren, um den pH-Wert zu kontrollieren
