
Inhaltsverzeichnis:
- Autor Miles Stephen [email protected].
- Public 2024-01-18 08:12.
- Zuletzt bearbeitet 2025-01-22 16:55.
Befolgen Sie diese Regeln, um einfache Redoxgleichungen auszugleichen:
- Schreiben das Oxidation und die Ermäßigung halb- Reaktionen für die Spezies das ist reduziert oder oxidiert .
- Multiplizieren Sie die Hälfte- Reaktionen durch die entsprechende Zahl, so dass sie die gleiche Anzahl von Elektronen haben.
- Füge die beiden hinzu Gleichungen um die Elektronen auszulöschen.
Außerdem, was ist Oxidation und Reduktion am Beispiel?
Die Ermäßigung ist der Vorgang, bei dem ein oder mehrere Elektronen aufgenommen werden. In einem (n Oxidation - die Ermäßigung oder Redoxreaktion, ein Atom oder eine Verbindung stiehlt Elektronen von einem anderen Atom oder einer anderen Verbindung. Ein Klassiker Beispiel einer Redoxreaktion rostet. Sauerstoff bekommt reduziert während Eisen bekommt oxidiert.
Wissen Sie auch, was Oxidation verursacht? Die Hauptakteure für Korrosion und Oxidation sind Sauerstoff und Luftfeuchtigkeit. Es ist eine chemische Reaktion der Metalloberfläche mit dem Sauerstoff, die Ursachen ein Teil des Metalls korrodiert (oder oxidiert) und bildet die Oxidation oder besser bekannt als Metall Oxid an der Oberfläche.
Wie bestimmt man in diesem Zusammenhang Oxidation und Reduktion?
Heim
- Weisen Sie allen Atomen in der Gleichung Oxidationszahlen zu.
- Vergleichen Sie die Oxidationszahlen von der Reaktantenseite mit der Produktseite der Gleichung.
- Das oxidierte Element ist dasjenige, dessen Oxidationszahl zugenommen hat.
- Das reduzierte Element ist dasjenige, dessen Oxidationszahl abgenommen hat.
Was ist ein Beispiel für eine Redoxreaktion im täglichen Leben?
Zu den alltäglichen Redoxreaktionen gehören Photosynthese, Atmung, Verbrennung und Korrosion.
Empfohlen:
Wie schreibt man die Formel für eine Verbindung, die ein mehratomiges Ion enthält?
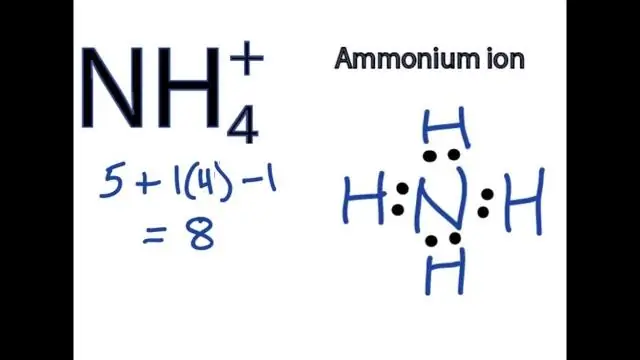
Um Formeln für Verbindungen mit mehratomigen Ionen zu schreiben, schreiben Sie das Symbol für das Metallion gefolgt von der Formel für das mehratomige Ion und gleichen Sie die Ladungen aus. Um eine Verbindung mit einem mehratomigen Ion zu benennen, geben Sie zuerst das Kation und dann das Anion an
Wie schreibt man PbO?

Eine Beschreibung, wie der Name für PbO, Blei(II)-Oxid geschrieben wird. Zunächst bestimmen wir anhand des Periodensystems, ob PbO eine ionische oder eine molekulare (kovalente) Verbindung ist. Aus dem Periodensystem ist Pb ein Metall und O ein Nichtmetall. Daher ist PbO eine ionische Verbindung, da es aus einem Metall und einem Nichtmetall besteht
Wie schreibt man eine Gleichung in Punktsteigungsform bei zwei Punkten?

Es gibt verschiedene Formen, in denen wir die Gleichung einer Geraden schreiben können: die Punkt-Steigungs-Form, die Steigungs-Achsen-Form, die Standardform usw. Die Gleichung einer Geraden gegeben zwei Punkte (x1, y1) und (x2, y2 ) durch die die Linie geht ist gegeben durch ((y - y1)/(x - x1)) / ((y2 - y1)/(x2 - x1))
Wie schreibt man einen negativen Exponenten um?
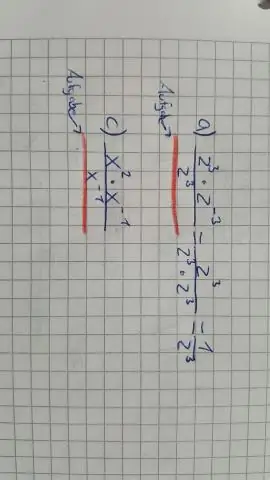
Um den negativen Exponenten in einen positiven Exponenten umzuschreiben, nehmen Sie den Kehrwert der Basis a. Klicke hier. Sehen Sie sich den Ausdruck an und suchen Sie den negativen Exponenten. Um den negativen Exponenten in einen positiven Exponenten umzuschreiben, nehmen Sie den Kehrwert von basea
Wie schreibt man Jeans wie in Genetik?

Wilhelm Johannsen, ein dänischer Botaniker, prägte 1909 den Begriff Gen, um die grundlegende Einheit der Vererbung zu beschreiben, aus dem deutschen Wort Gen. Gene ist die Pluralform, die Singularform ist Gen. Jeans sind Hosen aus schwerer Baumwolle, meist Denim
