
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:33.
- Zuletzt bearbeitet 2025-01-22 16:55.
Das ideale Gasgesetz ist, wie das Sprichwort sagt, tatsächlich PV = nRT , mit allen Standardvariablen. Hier ist n=m/M, wobei m die Masse des Gases und M das Molekulargewicht des Gases ist. Kurz gesagt das R in PV = nRT wird um einen Faktor M (Molekulargewicht) herunterskaliert, um R in. zu erhalten PV = mRT.
Also, was ist r gleich in pV nRT?
Das ideale Gasgesetz lautet: pV = nRT , wobei n die Molzahl ist und R ist eine universelle Gaskonstante. Der Wert von R hängt von den beteiligten Einheiten ab, wird aber normalerweise bei S. I.-Einheiten angegeben als: R = 8,314 J/mol. Dies bedeutet, dass Sie für Luft den Wert verwenden können R = 287 J/kg.
Wofür steht R in der Chemie pV nRT? Die Einheiten der universellen Gaskonstanten R ergibt sich aus der Gleichung PV=n R T. Es steht fürRegnault.
Wofür steht in diesem Zusammenhang N in pV nRT?
. Ein physikalisches Gesetz, das die Beziehung der messbaren Eigenschaften eines idealen Gases beschreibt, wobei P (Druck) × V (Volumen) = (Molzahl) × R (die Gaskonstante) × T (Temperatur in Kelvin) ist. Es leitet sich aus einer Kombination der Gasgesetze von Boyle, Charles und Avogadro ab. Auch als universelles Gasgesetz bezeichnet.
Was ist M im idealen Gasgesetz?
Das Original Ideales Gasgesetz verwendet die Formel PV =nRT, die Dichteversion des Ideales Gasgesetz ist PM = dRT, wobei P der in Atmosphären (atm) gemessene Druck ist, T die in Kelvin gemessene Temperatur (K), R der Ideales Gasgesetz konstant0,0821 at m (L) m ol(K) wie in der Originalformel, aber m ist nun die Molmasse (g m ol
Empfohlen:
Was ist der Unterschied zwischen der P-Generation f1-Generation und der f2-Generation?

P bedeutet Elterngeneration und sie sind die einzigen reinen Pflanzen, F1 bedeutet erste Generation und sie alle sind Hybriden, die das dominante Merkmal aufweisen, und F2 bedeutet zweite Generation, die die Enkel von P sind. Wenn ein Individuum ein dominantes Allel hat, wird es zeigen
Was ist der Unterschied zwischen der Kontinentaldrift-Meeresbodenspreizung und der Plattentektonik?

Die Kontinentaldrifttheorie wurde entwickelt, um zu erklären, wie die Ausbreitung des Meeresbodens die Kontinente beeinflussen muss. Die Theorie der Plattentektonik wurde entwickelt, um die Lage von ozeanischen Gräben, Vulkanen und die Lage verschiedener Arten von Erdbeben zu erklären
Was ist der Unterschied zwischen der Masse eines Protons und der Masse eines Elektrons?
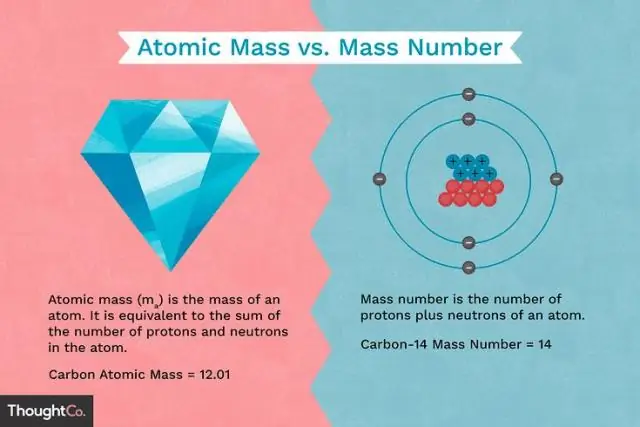
Protonen und Neutronen haben ungefähr die gleiche Masse, aber sie sind beide viel massiver als Elektronen (ungefähr 2.000 Mal so massiv wie ein Elektron). Die positive Ladung eines Protons ist betragsmäßig gleich der negativen Ladung eines Elektrons
Was ist der Unterschied zwischen der Arrhenius-Definition und der Brønsted-Lowry-Definition von Säuren und Basen?

Der Unterschied zwischen den drei Theorien besteht darin, dass die Arrhenius-Theorie besagt, dass die Säuren immer H+ und die Basen immer OH- enthalten. Während das Bronsted-Lowry-Modell behauptet, dass Säuren Protonendonatoren und Pronakzeptoren sind, müssen Basen kein OH- enthalten, also geben Säuren ein Proton an Wasser ab und bilden H3O+
Was ist der Unterschied zwischen der räumlichen Perspektive und der ökologischen Perspektive in der Geographie?
Was ist der Unterschied zwischen der ökologischen Perspektive und der räumlichen Perspektive in der Geographie? die räumliche Perspektive ist, wo etwas passiert oder wo etwas ist. die ökologische Perspektive ist die Wechselwirkung zwischen den Dingen in der Umwelt
