
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Jedes Element Emission Spektrum ist anders, weil jedes Element hat ein unterschiedlich Satz von Elektronenenergieniveaus. Die Emission Linien entsprechen den Unterschieden zwischen verschiedenen Paaren der vielen Energieniveaus. Die Linien (Photonen) werden emittiert, wenn Elektronen von Orbitalen höherer Energie auf niedrigere Energien fallen.
Außerdem, warum erzeugen verschiedene Elemente eine unterschiedliche Anzahl von Spektrallinien?
Die Frequenzen sind charakteristisch für die Eigenschaften des Kerns und der Zahlen der Elektronen verteilt auf die verschieden "Muscheln." Nach der Quantenmechanik gibt es ein Maximum Anzahl von Elektronen in jeder gebundenen Schale erlaubt. Deshalb verschiedene Elemente haben verschiedene diskrete Emissionsfrequenzen.
Zweitens, warum sind einige Spektrallinien heller als andere? In Wasserstoff Spektrum , einige Spektrallinien sind heller als andere abhängig von ihrem Energieniveau. Diese helle Linien zeigen, dass Elektronen von einem höheren Energieniveau auf ein niedrigeres Energieniveau gesprungen sind. Also in Wasserstoff Spektrum einige Linien sind heller als andere.
Was bedeuten die verschiedenen Farben in einem Linienspektrum in dieser Hinsicht? Warum sind die Spektren für jedes Element einzigartig?
Jedes Element hat sein eigenes einzigartiges Linienspektrum und wird daher als „Fingerabdruck“für eine bestimmte Person bezeichnet Element . Die Spektren für jedes Element sind einzigartig da jedes Element enthält unterschiedlich viele Elektronen und somit unterschiedlich Energieniveaus.
Warum strahlt jedes Element eine andere Farbe aus?
Heizung ein Atom regt seine Elektronen an und sie springen auf höhere Energieniveaus. Wenn die Elektronen auf niedrigere Energieniveaus zurückkehren, werden sie emittieren Energie in Form von Licht. Jedes Element hat ein unterschiedlich Elektronenzahl und a unterschiedlich Reihe von Energieniveaus. Daher, jedes Element emittiert ein eigener Satz von Farben.
Empfohlen:
Warum sehen Farben bei unterschiedlicher Beleuchtung unterschiedlich aus?

Objekte erscheinen in unterschiedlichen Farben, weil sie einige Farben (Wellenlängen) absorbieren und andere Farben reflektieren oder durchlassen. Zum Beispiel sieht ein rotes Hemd rot aus, weil die Farbstoffmoleküle im Stoff die Wellenlängen des Lichts vom violetten/blauen Ende des Spektrums absorbiert haben
Warum werden der führende und der nachlaufende Strang unterschiedlich repliziert?

Aufgrund der antiparallelen Ausrichtung der beiden chromosomalen DNA-Stränge wird ein Strang (Leading Strang) meist prozessiv repliziert, während der andere (Lagging Strang) in kurzen Abschnitten, den sogenannten Okazaki-Fragmenten, synthetisiert wird
Warum ist das Absorptionsspektrum für Chlorophyll a und das Wirkungsspektrum für die Photosynthese unterschiedlich?
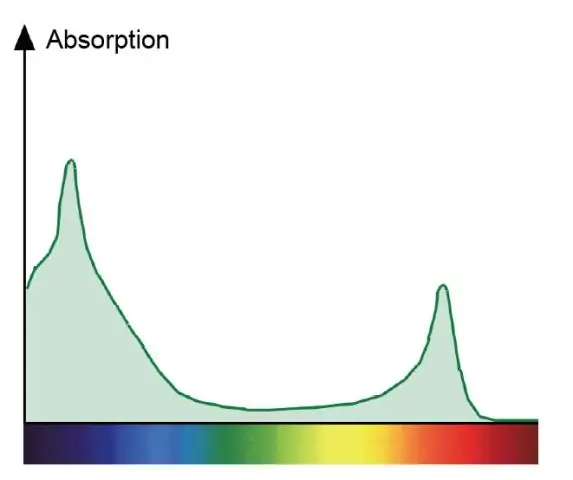
Ein Absorptionsspektrum zeigt alle Farben des von einer Pflanze absorbierten Lichts. Ein Aktionsspektrum zeigt alle Farben des Lichts, die bei der Photosynthese verwendet werden. Chlorophylle sind die grünen Pigmente, die Rot und Blau absorbieren und direkt an der Photosynthese teilnehmen
Warum sehen Kartenprojektionen unterschiedlich aus?

Wir haben viele verschiedene Kartenprojektionen, weil jede unterschiedliche Verzerrungsmuster aufweist – es gibt mehr als eine Möglichkeit, eine Orangenhaut abzuflachen. Einige Projektionen können sogar bestimmte Merkmale der Erde beibehalten, ohne sie zu verzerren, obwohl sie nicht alles erhalten können
Warum sehen Erde und Mond so unterschiedlich aus?

Da die Umlaufbahn des Mondes elliptisch ist und sich schneller bewegt, wenn er der Erde am nächsten ist, und langsamer, wenn er am weitesten entfernt ist, ändert sich die sichtbare Mondfläche geringfügig, ein Phänomen, das als Mondlibration bekannt ist
