
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-06-01 05:03.
Während alle Moleküle voneinander angezogen werden, sind einige Anziehungskräfte stärker als andere. Unpolare Moleküle werden durch a. angezogen Londoner Streuung Attraktion; polare Moleküle werden durch beide angezogen Londoner Streuung Kraft und der Stärkere Dipol - Dipol Attraktion.
Die Leute fragen auch, ob der Dipoldipol stärker ist als die Londoner Dispersion?
Alle Moleküle, egal ob polar oder unpolar, werden voneinander angezogen von Londoner Dispersionskräfte zusätzlich zu allen anderen attraktiven Kräfte das kann vorhanden sein. Im Allgemeinen ist jedoch Dipol - Dipol Wechselwirkungen in kleinen polaren Molekülen sind signifikant stärker als die Londoner Dispersionskräfte , so dass erstere überwiegen.
Anschließend stellt sich die Frage, was sind Beispiele für Londoner Dispersionskräfte? Diese Londoner Dispersionskräfte finden sich häufig in den Halogenen (z. B. F2 und ich2), der Adlige Gase (z. B. Ne und Ar) und in anderen unpolaren Molekülen, wie Kohlendioxid und Methan . Londoner Dispersionskräfte sind Teil der Van-der-Waals-Kräfte oder schwachen intermolekularen Anziehungskräfte.
Was ist in Anbetracht dessen die Dipoldipol-London-Dispersion?
Die Londoner Streuung Kraft ist eine vorübergehende Anziehungskraft, die entsteht, wenn die Elektronen in zwei benachbarten Atomen Positionen einnehmen, die die Atome vorübergehend bilden lassen Dipole . Diese Kraft wird manchmal als induzierte bezeichnet Dipol -induziert Dipol Attraktion.
Was ist die stärkste intermolekulare Kraft?
Wasserstoffbrückenbindungen
Empfohlen:
Was ist der Unterschied zwischen der P-Generation f1-Generation und der f2-Generation?

P bedeutet Elterngeneration und sie sind die einzigen reinen Pflanzen, F1 bedeutet erste Generation und sie alle sind Hybriden, die das dominante Merkmal aufweisen, und F2 bedeutet zweite Generation, die die Enkel von P sind. Wenn ein Individuum ein dominantes Allel hat, wird es zeigen
Was ist der Unterschied zwischen der Kontinentaldrift-Meeresbodenspreizung und der Plattentektonik?

Die Kontinentaldrifttheorie wurde entwickelt, um zu erklären, wie die Ausbreitung des Meeresbodens die Kontinente beeinflussen muss. Die Theorie der Plattentektonik wurde entwickelt, um die Lage von ozeanischen Gräben, Vulkanen und die Lage verschiedener Arten von Erdbeben zu erklären
Was ist der Unterschied zwischen der Masse eines Protons und der Masse eines Elektrons?
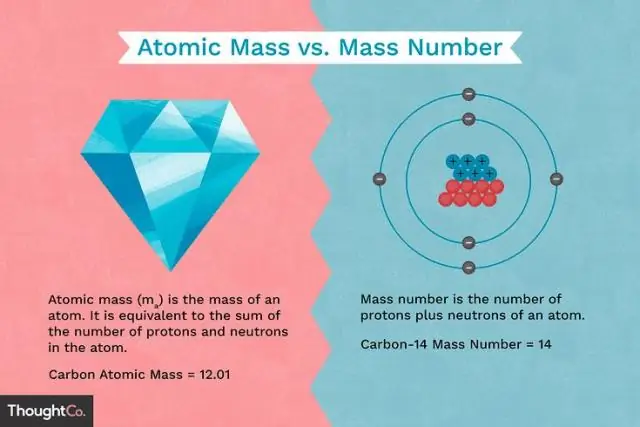
Protonen und Neutronen haben ungefähr die gleiche Masse, aber sie sind beide viel massiver als Elektronen (ungefähr 2.000 Mal so massiv wie ein Elektron). Die positive Ladung eines Protons ist betragsmäßig gleich der negativen Ladung eines Elektrons
Was ist der Unterschied zwischen der Arrhenius-Definition und der Brønsted-Lowry-Definition von Säuren und Basen?

Der Unterschied zwischen den drei Theorien besteht darin, dass die Arrhenius-Theorie besagt, dass die Säuren immer H+ und die Basen immer OH- enthalten. Während das Bronsted-Lowry-Modell behauptet, dass Säuren Protonendonatoren und Pronakzeptoren sind, müssen Basen kein OH- enthalten, also geben Säuren ein Proton an Wasser ab und bilden H3O+
Was ist der Unterschied zwischen der räumlichen Perspektive und der ökologischen Perspektive in der Geographie?
Was ist der Unterschied zwischen der ökologischen Perspektive und der räumlichen Perspektive in der Geographie? die räumliche Perspektive ist, wo etwas passiert oder wo etwas ist. die ökologische Perspektive ist die Wechselwirkung zwischen den Dingen in der Umwelt
