
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Warum sind die beiden Komponenten einer galvanischen Zelle getrennt? von einander? Die Metalle werden halbiert Zellen die durch eine Salzbrücke verbunden sind. Die Bewegung der Elektronen von der Anode zur Kathode ist der elektrische Strom.
Warum sind hier die beiden Komponenten der Zelle voneinander getrennt?
In einer galvanischen Zelle es gibt zwei halb- Zellen . Jeder halb- Zelle enthält eine Elektrode in einem Elektrolyten. Die Trennung ist notwendig, um einen direkten chemischen Kontakt der Oxidations- und Reduktionsreaktionen zu verhindern, wodurch eine Potentialdifferenz entsteht.
Wissen Sie auch, wofür galvanische Zellen verwendet werden? Galvanische Zellen . Unter anderem Zellen , ein galvanisch Zelle ist eine Art von elektrochemisch Zelle. es ist Gebraucht um elektrischen Strom zu liefern, indem die Elektronen durch eine Redoxreaktion übertragen werden. EIN galvanisch cell ist eine beispielhafte Idee, wie Energie durch einfache Reaktionen zwischen wenigen gegebenen Elementen nutzbar gemacht werden kann.
Warum gibt es 2 Halbzellen in einer elektrochemischen Zelle?
Elektrochemische Zellen bestehen typischerweise aus zwei halbe - Zellen . Die Hälfte - Zellen trennen das Oxidation halb -Reaktion von das die Ermäßigung halb -Reaktion und ermöglichen den Stromfluss durch einen externen Draht. Reduktion erfolgt um das Kathode. Das Hinzufügen einer Salzbrücke ist abgeschlossen das Stromkreis fließen lassen.
Welche zwei Arten von elektrochemischen Zellen gibt es?
Zwei Arten von Zelle Es gibt zwei grundlegend Arten von elektrochemischen Zellen : galvanisch und elektrolytisch. Galvanische Zellen chemische potentielle Energie in elektrische Energie umwandeln. Die Energieumwandlung wird durch spontane (ΔG < 0) Redoxreaktionen erreicht, die einen Elektronenfluss erzeugen.
Empfohlen:
Wie unterscheidet sich die Form einer Pflanzenzelle von der einer tierischen Zelle?
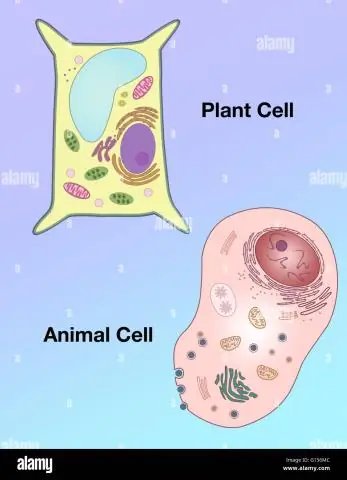
Vakuolen: Pflanzenzellen haben eine große Vakuole, während tierische Zellen mehrere kleine Vakuolen enthalten. Form: Pflanzenzellen haben eine regelmäßigere Form (im Allgemeinen rechteckig), während tierische Zellen unregelmäßige Formen haben. Lysosomen: kommen im Allgemeinen in tierischen Zellen vor, während sie in Pflanzenzellen fehlen
Aus welchen Komponenten besteht eine elektrochemische Zelle?

(a) Komponenten der elektrochemischen Zellelektrode: Es ist ein massiver elektrischer Leiter aus Metall (manchmal nichtmetallisch wie Graphit). Eine Zelle besteht aus zwei Elektroden. Eine heißt Anode und die andere heißt Kathode. Elektrolyt: Es besteht aus Lösungen von Ionen oder geschmolzenen Salzen, die Strom leiten können
Was sind die beiden Hauptteile des Zellzyklus und was passiert mit der Zelle in jedem Stadium?
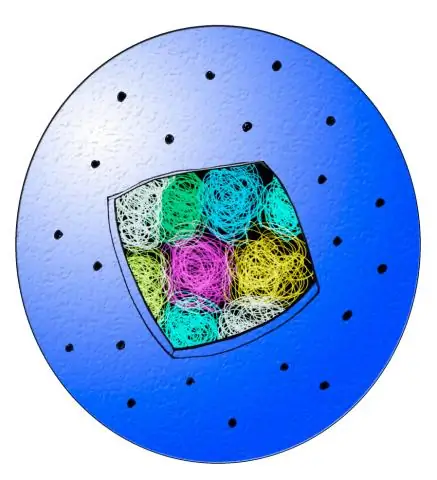
Es gibt zwei Hauptstadien im Zellzyklus. Die erste Phase ist die Interphase, in der die Zelle wächst und ihre DNA repliziert. Die zweite Phase ist die mitotische Phase (M-Phase), in der sich die Zelle teilt und eine Kopie ihrer DNA auf zwei identische Tochterzellen überträgt
Wo findet Oxidation in einer galvanischen Zelle statt?

In einer voltaischen Zelle erfolgt die Oxidation und Reduktion von Metallen an den Elektroden. In einer Voltaic-Zelle befinden sich zwei Elektroden, eine in jeder Halbzelle. An der Kathode findet die Reduktion statt und an der Anode findet die Oxidation statt
Warum hat sich die Tinte getrennt?

Wenn das Wasser das Papier hochkriecht, werden die Farben in ihre Bestandteile zerlegt. Durch die Kapillarwirkung wandert das Lösungsmittel das Papier hinauf, wo es auf die Tinte trifft und diese auflöst. Die gelöste Tinte (die mobile Phase) wandert langsam das Papier (die stationäre Phase) hinauf und trennt sich in verschiedene Komponenten
