
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-01-22 16:55.
Also, wir Berechnung es durch die gewichtete Masse von jedem der Isotope und addieren sie zusammen. Also erstmal Masse , wir multiplizieren 0,50% von 84 (amu - Atommasse Einheiten) = 0,042 amu und addiere es zu 9,9% von 86 amu = 8,51 amu und so weiter.
Anschließend kann man sich auch fragen, wie berechnet man die durchschnittliche Atommasse?
Berechnung der durchschnittlichen Atommasse Die durchschnittliche Atommasse eines Elements ist die Summe der Massen seiner Isotope, jedes multipliziert mit seiner natürlichen Häufigkeit (die Dezimalzahl, die mit dem Prozentsatz von Atome dieses Elements, die von einem gegebenen Isotop sind). Durchschnittliche Atommasse = f1m1 + f2m2 +…
Wissen Sie auch, welche drei Arten von Informationen benötigt werden, um eine durchschnittliche Atommasse zu berechnen? Die Anzahl der Isotope, die für das Element existieren. Die Atomar Nummer für das Element. Die prozentuale Häufigkeit jedes Isotops.
Man kann sich auch fragen, welcher Wert der Atommasse von Strontium am nächsten kommt?
Strontium . In ihrem Bericht von 1961 empfahl die Kommission AR(Sr) = 87,62 basierend auf dem Masse -spektrometrische Bestimmung von Nier. Dies Wert wurde zu A revised überarbeitetR(Sr) = 87,62(1) im Jahr 1969 und bleibt seitdem unverändert.
Was hat eine Masse von 1 amu?
Eine atomare Masseneinheit (symbolisiert AMU oder Amu) ist definiert als genau 1/12 der Masse eines Atoms von Kohlenstoff-12. Das Kohlenstoffatom 12 (C-12) hat sechs Protonen und sechs Neutronen in seinem Kern. Ungenau ist eine AMU der Durchschnitt der Proton Ruhemasse und die Neutron Restmenge.
Empfohlen:
Wie berechnet man die Standardabweichung von PMP?

Die im PMBOK verwendete Formel für die Standardabweichung ist einfach. Es ist nur (P-O)/6. Das ist die pessimistische Aktivitätsschätzung minus der optimistischen Aktivitätsschätzung geteilt durch sechs. Das Problem ist, dass diese Form in keiner Weise ein Maß für die Standardabweichung ergibt
Was ist die durchschnittliche Atommasse eines Atoms?

Die durchschnittliche Atommasse eines Elements ist die Summe der Massen seiner Isotope, jedes multipliziert mit seiner natürlichen Häufigkeit (die Dezimalzahl, die mit dem Prozentsatz der Atome dieses Elements eines bestimmten Isotops verbunden ist). Durchschnittliche Atommasse = f1M1 + f2M2 +
Wie wird die durchschnittliche Atommasse im Periodensystem bestimmt?

Die durchschnittliche Atommasse eines Elements wird berechnet, indem die Massen der Isotope des Elements summiert werden, wobei jedes mit seiner natürlichen Häufigkeit auf der Erde multipliziert wird. Verwenden Sie bei Massenberechnungen mit Elementen oder Verbindungen immer die durchschnittliche Atommasse, die im Periodensystem zu finden ist
Wie berechnet man die Atommasse von Bor?
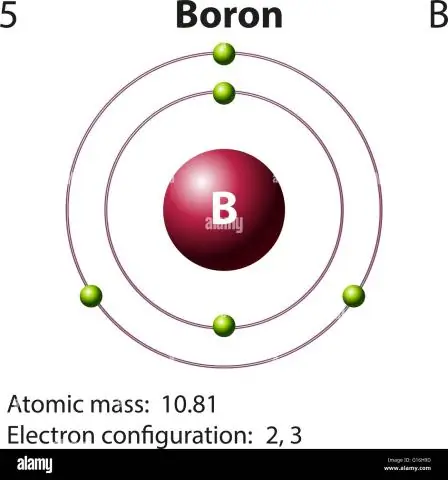
Für Bor sieht diese Gleichung so aus: 5 Protonen + 5 Neutronen = 10 Atommasseneinheiten (AMU) bzw. für das häufiger vorkommende Borisotop (ca. 5 Protonen + 6 Neutronen = 11 AMU
Wie berechnet man die Zeit, die man braucht, um eine Strecke zurückzulegen?

Schätzen Sie, wie schnell Sie auf Ihrer Reise sein werden. Dann teilen Sie Ihre Gesamtstrecke durch Ihre Geschwindigkeit. Dies gibt Ihnen eine Einschätzung Ihrer Reisezeit. Wenn Ihre Fahrt beispielsweise 240 Meilen beträgt und Sie 40 Meilen pro Stunde fahren werden, beträgt Ihre Zeit 240/40 = 6 Stunden
