
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:32.
- Zuletzt bearbeitet 2025-06-01 05:03.
Basizität. Im Vergleich zu Aminen Amide sind sehr schwache Basen. Während die konjugierte Säure eines Amins einen pKein von etwa 9,5, die konjugierte Säure von an Amid hat einen pKein um -0,5. Deswegen, Amide haben in Wasser keine so deutlich wahrnehmbaren Säure-Basen-Eigenschaften.
Auch gefragt, was ist der pKa-Wert eines Amins?
Der Wert von 10,63 bezieht sich eigentlich auf die pKa der konjugierten Säure von Methyl Amin , NICHT Methylamin selbst. Es ist ein pKaH-Wert. In ähnlicher Weise führt dieselbe Tabelle Trimethylamin mit a pKa von 9.8.
Können Amide auch protoniert werden? EIN protoniertes Amid besitzt die am wenigsten saure Gruppe von allen (CONH+), ein Beweis dafür, dass die blinkende Resonanzform in diesem Fall einen überwältigenden Beitrag leistet. Das einsame Elektronenpaar auf NH2 ist stark delokalisiert zur Carbonylgruppe in Amide . Eigentlich ist das C=O. Gruppe von an Amid ist basischer als NH2.
In ähnlicher Weise können Sie sich fragen, wie hoch der pKa-Wert von Hydroxid ist.
Hydroxid Ion, HO(-) befindet sich nicht auf der linken Seite des pKa Tabelle, aber es ist auf dem "inversen" pKa Tabelle - es ist die konjugierte Base von Wasser, H2O. Wasser hat a pKa von ~15 und CH4 hat ein pKa von 50. Unser Produkt ist eine stärkere Säure. Von der Umkehrung pKa Tabelle beachten wir auch, dass CH3(-) ist eine stärkere Base als HO(-).
Warum sind Amide basisch?
Im Gegensatz zu Aminen, die anständige Basen sind, Amide sind schwache Basen. Die konjugierten Säuren von Amide haben pKa-Werte von etwa -0,5. Der Grund Amide sind nicht so Basic ist auf die Anwesenheit der Carbonylgruppen zurückzuführen. Amide können auch Wasserstoffbrücken bilden, da sie eine N-H-Bindung enthalten.
Empfohlen:
Was ist der Hauptunterschied zwischen dem Ablesen eines Tiefenmikrometers und eines Außenmikrometers?

Diese Klassifizierung hat drei Unterteilungen: Innen-, Außen- und Tiefenmikrometer. Inside wurde entwickelt, um den Innendurchmesser eines Objekts zu messen. Außen misst den Außendurchmesser, die Dicke von etwas und die Länge. Tiefe ist die Tiefe von Löchern zu messen
Was ist der Unterschied zwischen der Masse eines Protons und der Masse eines Elektrons?
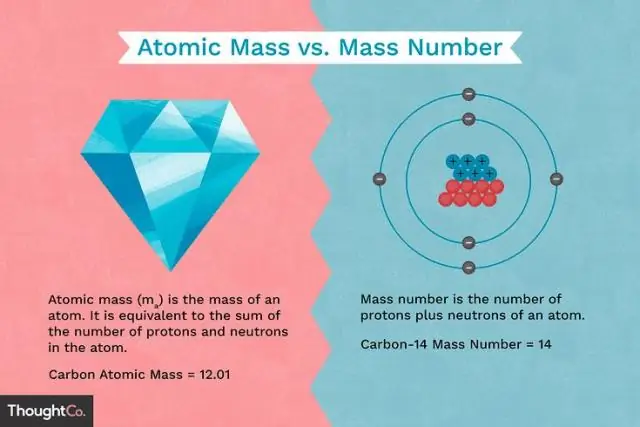
Protonen und Neutronen haben ungefähr die gleiche Masse, aber sie sind beide viel massiver als Elektronen (ungefähr 2.000 Mal so massiv wie ein Elektron). Die positive Ladung eines Protons ist betragsmäßig gleich der negativen Ladung eines Elektrons
Was ist der ungefähre pKa-Wert eines Thiols?

6.4 Auch gefragt, was ist der pKa von Thiol? Thiole sind durchschnittlich etwa 5. saurer als Alkohole pKa Einheiten oder so ( pKa von etwa 11 für die Thiol unten abgebildet). Erinnere dich daran pKa ist logarithmisch, das heißt, sie sind ungefähr 10 5 mal saurer.
Was ist der Prozess, der eine neue Kopie der genetischen Information eines Organismus erzeugt?

Der Prozess der DNA-Replikation erzeugt eine neue Kopie der genetischen Information eines Organismus, die an eine neue Zelle weitergegeben wird. Frei schwebende Nukleotide werden durch ein Enzym namens Polymerase mit ihren Komplementen abgeglichen. Dies sind die 'Gebäude'. Sie bauen einen neuen DNA-Strang entlang jedes der alten Stränge zusammen
Was passiert mit der Temperatur eines Stoffes während eines Phasenwechsels?

Während eines Phasenwechsels bleibt die Temperatur eines Stoffes konstant. Wir beobachten häufig Phasenänderungen von fest zu flüssig, wie zum Beispiel das Schmelzen von Eis. Dies liegt daran, dass die den Eismolekülen zugeführte Wärmemenge dazu verwendet wird, ihre kinetische Energie zu erhöhen, was sich in einer Temperaturerhöhung widerspiegelt
